非洲猪瘟 (African Swine Fever, ASF) 是由非洲猪瘟病毒 (African Swine Fever Virus, ASFV) 引起的一种急性、烈性、高度接触性传染病, 严重危害着全球养猪业。2007年以来, 非洲猪瘟在全球多个国家发生、扩散、流行, 特别是俄罗斯及其周边地区, 给我国养猪业带来了严重威胁。因此, 为切实做好非洲猪瘟疫情防范工作, 本文从病原学、流行病学、临床及实验室诊断、风险因素、综合防控等各个方面对其进行综述, 加强人民对非洲猪瘟的认识, 增强各猪场及进出口岸对非洲猪瘟的检疫防范意识, 加大检验力度, 为防止非洲猪瘟传入我国打下基础。
关键词:
非洲猪瘟; 流行病学; 诊断; 风险因素; 综合防控;
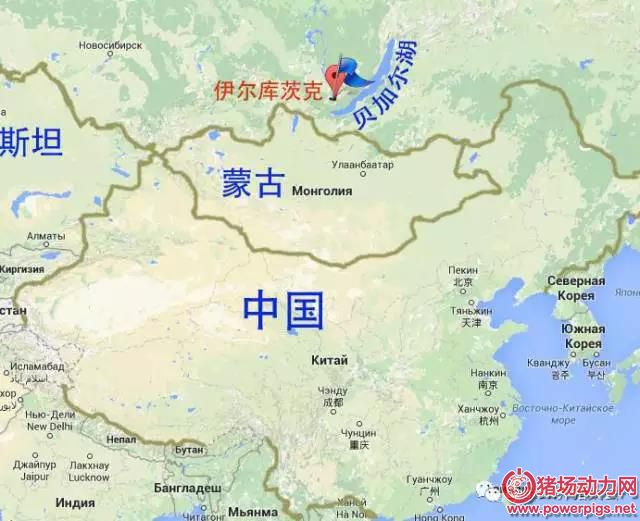
非洲猪瘟 (ASF) 是由非洲猪瘟病毒 (ASFV) 引起的一种急性、烈性、高度接触性的传染病, 其发病率高, 死亡率可高达100%, 世界动物卫生组织 (OIE) 将其列为必须报告动物疫病, 我国将其列为一类动物疫病。该病最早在1921年于非洲的肯尼亚国家确认发生, 2007年以来, 非洲猪瘟在全球多个国家发生、扩散、流行, 特别是俄罗斯及其周边地区。2017年3月, 俄罗斯远东地区伊尔库茨克州发生非洲猪瘟疫情, 疫情发生地距离我国较近, 仅为1000km左右;另外, 我国是养猪及猪肉消费大国, 生猪出栏量、存栏量以及猪肉消费量均位于全球首位, 每年种猪及猪肉制品进口总量巨大, 与多个国家贸易频繁;而且, 我国与其它国家的旅客往来频繁, 旅客携带的商品数量多、种类杂。因此, 非洲猪瘟传入我国的风险日益加大, 一旦传入, 其带来的直接以及间接损失将不可估量。对此, 2017年4月12日, 我国农业部发布了关于进一步加强非洲猪瘟风险防范工作的紧急通知。
为切实做好非洲猪瘟疫情防范工作, 本文从非洲猪瘟的病原学、流行病学、临床及实验室诊断、风险因素、综合防控等各个方面进行综述, 以期加强人民对非洲猪瘟的认识, 增强各猪场及进出口岸对非洲猪瘟的检疫防范意识, 加大各部门的检验力度, 为防止非洲猪瘟传入我国打下基础。
1 病原学
1.1 分类及形态结构
2005年7月, 国际病毒分类委员会 (ICTV) 最新病毒分类第八次报告中指出, 非洲猪瘟病毒属于DNA病毒目, 非洲猪瘟病毒科, 非洲猪瘟病毒属成员, 是一种具有20面体结构, 直径为175~215nm, 基因组全长170~190kb, 含有151个开放阅读框, 可编码150~200种蛋白, 具有囊膜的双股线性DNA病毒。非洲猪瘟病毒是由病毒基因组、完成基因早期转录所必须的酶以及一些DNA结合蛋白组成, 结构蛋白较多, 其中p72是主要的结构蛋白之一, 占病毒总蛋白量的1/3, 而且该蛋白序列保守, 抗原性佳, 病毒感染后能够产生高滴度的抗p72抗体, 因此常被用作非洲猪瘟的血清学诊断;另外, 根据p72基因末端一段478bp的核酸序列, 非洲猪瘟可分为23个基因型, 如Benin97/1为基因I型, Malawi Li20/1为基因VIII型, 东非埃塞尔比亚分离株属于基因XXIII型。非洲猪瘟病毒基因组变异频繁, 表现出明显的遗传多样性。非洲猪瘟病毒不能够诱导产生中和抗体, 因此还没有对血清型进行分类。
1.2 理化特性
非洲猪瘟病毒粒子在Percoll细胞分离液和氯化铯中的浮密度分别为1.095g/cm3和1.19~1.24g/cm3。该病毒为囊膜病毒, 能够抵抗蛋白酶的作用, 对乙醚及氯仿等脂溶剂敏感, 但易被胰酶灭活。病毒在p H 4~10的溶液中比较稳定, 但对温度非常敏感, 病毒可在5℃的血清中存活6年, 56℃加热70min或60℃加热30min可使其灭活。
1.3 体外生长特性
非洲猪瘟病毒体内感染的主要细胞类型为单核-巨噬细胞系统, 包括组织巨噬细胞和网状内皮细胞, 也能在鸡胚卵黄囊和骨髓细胞中增殖。在体外, 用于病毒分离培养的细胞分2类:一类为原代细胞, 主要为单核-巨噬细胞, 接种48h后, 细胞圆缩肿大, 随后脱落、溶解;另一类为传代细胞系, 比如猪肾细胞系 (PK) 、乳仓鼠肾细胞 (BHK-21) 、非洲绿猴肾细胞 (Vero) 以及猪睾丸细胞 (ST) 等, 但传代细胞对野毒株较不敏感。一些分离株已适应传代细胞系, 并可以产生细胞病变。
1.4 不同环境下的存活状态
非洲猪瘟病毒在环境中比较稳定, 能够在污染的环境中保持感染性超过3d, 在猪的粪便中感染能力可持续数周, 在死亡野猪尸体中可以存活长达1年;病毒在肉制食品中亦比较稳定, 冰冻肉中可存活数年, 半熟肉以及泔水可长时间存活, 腌制火腿中可存活数月, 未经烧煮或高温烟熏的火腿和香肠中能存活3~6个月, 4℃保存的带骨肉中至少存活5个月。
1.5、分子病原学
1.5.1、 病毒基因组结构
ASFV是一种单分子线状双链DNA病毒, 属于双链DNA病毒目, 非洲猪瘟病毒科, 非洲猪瘟病毒属, 也是ASFV家族中的唯一成员。病毒基因组末端以共价键闭合, 长度170~190kb, 含有151个开放性阅读框 (ORFs) , 可以编码150~200种蛋白质[2-3]。基因组中央是长约125kb的保守区, 左端48kb和右端22kb中间区域存在差异, 这也是不同分离株的基因组长度存在差异的主要原因[4]。采用限制性内切酶进行酶切图谱分析表明, 分离于美洲和欧洲的病毒株为同一个基因型, 而分离于非洲的毒株则具有多种基因型, 这进一步说明来自不同区域的毒株之间存在较大的基因型差异, 以及来自非洲以外地域的ASFV可能有着共同的起源。组织细胞适应株 (西班牙BA71V分离株) 是第一个被确定基因组全序列的毒株, 该毒株常作为实验室研究的重要对象[2]。目前, 11株ASFV全基因组序列已被测定, 其中1株为无毒力的西班牙BA71V分离株, 1株为有毒力的西班牙E75分离株, 1株低毒力毒株分离于葡萄牙软蜱体内, 剩余8株分离于非洲家猪或野猪体内[3]。
1.5.2、病毒形态结构特征
ASFV是一种正二十面体对称结构病毒, 病毒直径200nm, 其中直径为70~100nm的DNA核心位于病毒中间, 直径为172~191nm的二十面体衣壳和含类脂的囊膜包裹着病毒外周。衣壳呈二十面体对称, 由1 892~2 172个壳粒构成, 中心有孔, 呈六棱镜状, 壳粒间的间距为7.4~8.1nm[5]。成熟的病毒粒子由多层结构组成, 约含有50多种病毒编码蛋白质, 其中包括结构蛋白、基因转录和RNA加工所需的酶, 这些蛋白是构成病毒粒子结构的主要成分, 对病毒粒子的再次感染有着重要作用[6]。ASFV病毒粒子的形成发生于细胞核周围的“病毒加工厂”区域, 在病毒粒子形成的最初阶段, P72结构蛋白从细胞质中富集并与内质网膜结合, 然后在膜凸起的表面上形成衣壳, 在凹进的表面上形成衣壳心;在病毒装配阶段, 首先被病毒蛋白修饰后的内质网膜作为病毒粒子内膜, 随后P72蛋白被装配到病毒粒子之中, 同时多聚蛋白P220被酰基化后连接到未成熟的病毒粒子衣壳内膜, 接着病毒晚期结构蛋白P49得到表达, 形成二十面体病毒粒子。下一步是多聚蛋白P220和P62经S273R酶分解加工形成病毒核衣壳和有感染性的病毒粒子, 最后病毒粒子二十面体闭合, 病毒DNA嵌入及核心蛋白浓缩, 最终形成成熟的病毒粒子[7]。
构成病毒粒子的结构蛋白有P72, P49, P54, P220, P62, CD2v蛋白等, 其中P72蛋白表达于AS-FV感染晚期, 位于病毒衣壳的表面, 具有良好的反应原性和抗原性, 是病毒二十面体衣壳的重要组成成分, 参与病毒吸附过程以及病毒装配过程中P220和P62的加工, 除此, P72编码基因具有较高的同源性, 常用于ASFV基因的分型[8-10]。P54蛋白位于病毒颗粒类脂外膜上, 由病毒E183L基因编码, P54的差异表达可能会出现在细胞传代过程中;研究发现在该蛋白氨基末端含有跨膜区域, 因此P54蛋白在病毒感染过程中发挥重要作用, 尤其在病毒蛋白经内质网膜转化成病毒包膜前体时发挥着非常重要的作用[11]。P54蛋白含有一个LC8动力蛋白结合结构域, 可与8 000的轻链细胞质动力蛋白DLC8发生交叉反应, 并在病毒内化以及将病毒运输到复制区的过程中起着重要作用[12]。P220和P62为2种多聚蛋白前体, 是病毒感染的晚期蛋白, 经S273R酶加工成P150, P37, P34, P14, P35和P15蛋白, 这6种结构蛋白位于成熟的病毒粒子的核衣壳之中, 在病毒衣壳的装配过程中起着重要作用;研究发现P220和P62的正常加工是病毒粒子成熟的一个重要指标[13-14]。除此, 病毒粒子中还包含一些逃避宿主防御系统的蛋白, A238L是重要的免疫调节蛋白, 该病毒蛋白与细胞IkB蛋白具有同源性, 可以抑制机体NFkB转录因子和钙调磷蛋白磷酸酶的活性。CD2v与T细胞表面黏附因子CD2具有相似性, 其能使病毒颗粒吸附于红细胞表面, 同时该蛋白可以损坏淋巴细胞的功能;研究发现, CD2v的表达影响ASFV在家猪间的传播[15-16]。
2 流行病学
2.1 传染源
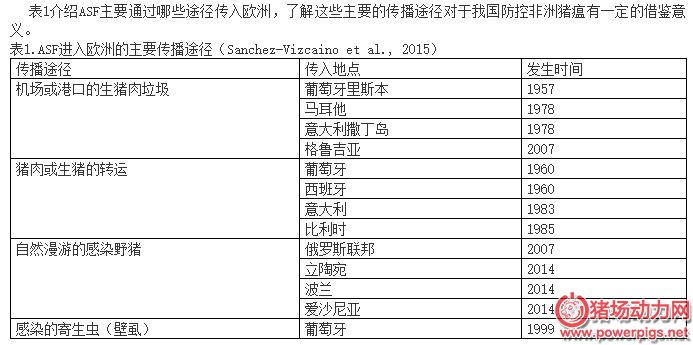
猪是非洲猪瘟病毒唯一的自然宿主, 除家猪和野猪外, 其它动物不感染该病毒。发病猪和带毒猪是非洲猪瘟病毒的主要传播宿主, 病猪各组织器官、体液、各种分泌物、排泄物中均含有高滴度的病毒, 因此可经病猪的唾液、鼻分泌物、泪液、尿液、粪便、生殖道分泌物以及破溃的皮肤、病猪血液等进行传播。欧洲野猪比较容易被病毒感染, 表现出的症状跟家猪相似, 有三种非洲野猪 (疣猪、大林猪、非洲野猪) 不表现出症状, 隐性带毒, 成为病毒的贮存器。非洲猪瘟病毒是唯一的虫媒DNA病毒, 软蜱是主要的传播媒介和贮存宿主。因此, 在非洲, 非洲猪瘟病毒在蜱和野猪感染圈中长期存在, 难以根除, 并在一定条件下感染家猪, 引起暴发。
另外, 猪肉及猪肉制品, 被污染的饲料、水源、器具、泔水、工作人员及其服装以及污染空气均能成为传染源, 经口和上呼吸道途径传播。
2.2 传播途径
非洲猪瘟的传播途径较为广泛。比如, 直接接触感染猪 (直接传播途径) , 饲喂污染的猪产品、饲料、泔水, 接触污染的粪便、垫料等 (间接传播途径) , 以及蜱媒介传播。根据俄罗斯相关部门的调查显示动物及动物产品的移动或接触、饲喂泔水是主要的传播方式。
2.3 流行现状
非洲猪瘟于1921年首次发现于非洲的肯尼亚地区, 1957年传入西欧, 1971年传入南美洲及中美洲地区, 随后一段时间内, 疫情较为稳定。2007年以来, 非洲猪瘟在全球多个国家发生、扩散、流行, 根据孙洪涛等人的调查分析, 截止到2015年, 全球约有52个国家发生过非洲猪瘟疫情或检测到病毒, 其中包括31个非洲国家、17个欧洲国家和4个拉丁美洲国家。根据翁善钢统计, 2016年共有10个国家的多个地区发生非洲猪瘟疫情, 分别是拉脱维亚, 乌克兰敖德萨市, 俄罗斯克拉斯诺达尔边疆区, 南非西北省和自由省, 摩尔多瓦敦杜舍尼区, 波德拉谢省, 立陶宛乌田纳县, 马里塞古省, 布隆迪恩戈齐, 肯尼亚西部州。
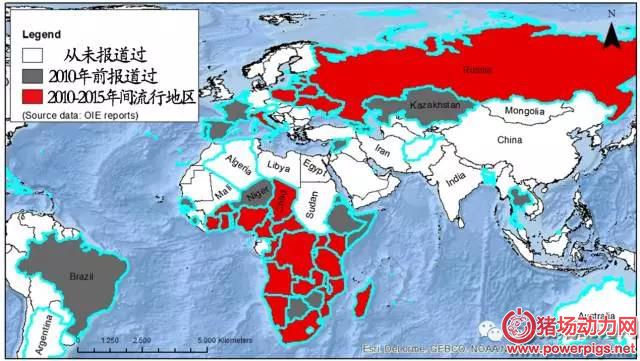
根据OIE通报, 截止2017年10月底, 全球共有11个国家 (波兰、拉脱维亚、立陶宛、乌克兰、俄罗斯、捷克、赞比亚、南非、摩尔多瓦、罗马尼亚、科特迪瓦) 发生非洲猪瘟疫情。其中波兰疫情数高达470多起, 拉脱维亚高达220多起, 立陶宛高达210多起, 三个国家疫情多发生于野猪;罗马尼亚首次发生该疫情, 感染动物为家猪, 感染来源尚不清楚;另外值得注意的是, 自2014年以来, 俄罗斯非洲猪瘟疫情严重, 今年又有多个地区发生, 截止目前疫情数高达120多起, 且绝大多数疫情发生于家猪。
2.4、分子流行病学
ASFV基因组变异频繁, 表现出明显的遗传多样性。根据ASFV P72蛋白C端编码基因的序列, 将ASFV分为22个基因型, 即P72基因Ⅰ型到基因Ⅹ, Ⅻ型。如果根据P54和PB602L基因的中央可变区 (CVR) 进行遗传分析, 可将P72基因分型进一步细化[22]。因此, 研究AS-FV的分子流行病学, 对病原的溯源和防控有着重要意义, 也为病毒的流行病学特征分析提供了新思路和方法。
2.4.1 ASF在非洲地区的流行现状
非洲大陆作为ASF流行的主要区域, 也是ASFV的最早的发源地, 近些年来, 非洲地区每年都有20多个国家出现ASF疫情, 并且多数呈地方性流行。目前, 肯尼亚、莫桑比克、纳米比亚、尼日利亚、卢旺达、南非、坦桑尼亚、多哥、乌干达和赞比亚等国家都相继暴发ASF[23-25]。DAVID等[26]在乌干达的健康生猪血清中, 发现具有较高的ASFV抗体阳性率, 然而, 其发病率较低, 这与乌干达家猪群中流行的是ASFV弱毒株是否有关, 还需进一步调查论证。在塞内加尔, JORI等[27]通过对流行病学和分子分型进行研究发现, 疣猪和O.sonrai蜱不太可能参与ASF的传播。2008年, 坦桑尼亚暴发ASF疫情, 通过对来自该地区的死亡家猪组织样品进行分析发现, 坦桑尼亚株 (2008株) 为P72基因型ⅩⅤ, 并与坦桑尼亚株 (2001株) 具有很高的同源性。流行病学调查表明, 活猪的运输对ASF在坦桑尼亚地区的传播过程中发挥了积极作用[28]。2011年, 有学者从坦桑尼亚无明显症状的猪样品中检测到ASFV的基因组, 进行遗传分析后发现其与欧洲毒株基因具有很高的相似性, 属于Ⅰ基因型Ⅱ (即格鲁吉亚2007/1株) , 由此推测该病毒可能是从欧洲国家传入坦桑尼亚, 而非来自其他非洲国家[29]。LUKA等[30]对来自于尼日利亚2007—2011年的样本中基因Ⅰ型的3个独立的基因组区域进行分析, 结果发现在P72和P54基因区域没有变化, P72序列的系统发育树表明所有的尼日利亚株都属于基因Ⅰ型;B602L基因分析结果表明四聚体重复数存在一定差异, 这将为ASFV进化流行病学信息提供依据。2011年2月, 埃塞俄比亚首次暴发ASF疫情, 采集埃塞俄比亚家猪的23个组织样品 (2011—2014年) , 进行ASFV基因组分析, 结果显示ASFV的部分P72基因序列为1个新的基因型[31]。对2010—2013年暴发于乌干达的ASFV进行遗传性相关分析, 发现了2个新的CVR亚型, 并且第1次对乌干达不同地域中ASFV的分子流行病学进行详细评估[32]。
2.4.2 ASF在高加索和欧洲地区的流行现状
2007年4月, 在欧洲地区再次出现ASF疫情, 随后在5个国家蔓延, 尤其在俄罗斯联邦及其周边的格鲁吉亚、亚美尼亚、阿塞拜疆等高加索地区流行情况更为严峻。由于该地区社会经济、政治和文化等复杂因素的影响, 特别是缺乏对ASF疫情的协调控制方案, 增加了ASF在该区域传播的风险, 目前, ASF疫情的扩散对受灾国家的经济造成严重影响[33-34]。研究者发现, 在高加索地区和俄罗斯发现的ASFV分离株存在相同的P72, P54和CVR序列, 这表明其来源于同一个ASFV毒株[35]。2007年格鲁吉亚出现大范围的ASF疫情, 随后在2007—2012年期间, 大量家猪和野猪感染ASFV, 研究发现该病毒的循环模式也许是其一直保持高致病性的重要原因[36]。有学者对长期流行于意大利撒丁岛的AS-FV进行变量序列分析, 发现该撒丁岛分离毒株的变异性较低, 证实了该地区的毒株存在显著的遗传稳定性[37]。2014年1月, 在立陶宛野猪群中首次出现ASF疫情, 随后GALLARDO等[38]采用2014年流行于欧盟的ASFVⅡ型毒株实验性感染家猪, 并对病毒学、病毒的水平传播、产生的临床症状和诱导家猪体液反应情况进行评估研究。2014年, 对流行于立陶宛和波兰的ASFV进行检测, 测序结果显示该毒株与白俄罗斯流行株 (2013年) 相似, 与流行于东欧的毒株同源性为100%, 但与格鲁吉亚分离毒株 (2007株) 存在一定差异性[39]。
3 临床症状及诊断
3.1 临床症状
非洲猪瘟病毒自然感染的潜伏期一般为4~19d。非洲野猪对该病有很强的抵抗力, 一般不表现出临床症状, 但家猪和欧洲野猪一旦感染, 则表现出明显的临床症状。根据病毒的毒力、感染剂量和感染途径的不同, 临床症状存在差异, 可表现为最急性、急性、亚急性或隐性感染。
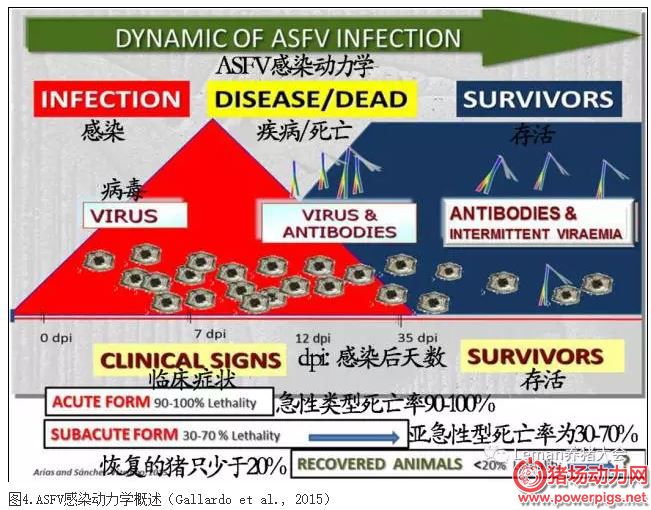
最急性型多发生在非洲地区, 往往无明显症状就突然倒地死亡。急性型表现为食欲减退, 高温 (达40~42℃) , 挤成一团, 共济失调, 心跳加快, 呼吸困难, 部分咳嗽, 眼、鼻有浆液性或粘液性脓性分泌物, 皮肤发绀和出血, 偶尔会出现呕吐和腹泻, 血液学检测会出现白细胞和淋巴细胞减少等。临床症状出现后7~10d内发生死亡, 死亡率高, 可达100%。
亚急性或慢性非洲猪瘟多发生在非洲以外的地区, 表现为妊娠母猪流产, 呼吸改变, 关节肿大, 跛行, 皮肤溃疡, 消瘦, 病死率低。
3.2 病理变化
非洲猪瘟病毒会引起多种病变类型, 这取决于病毒毒株的毒力。急性和亚急性以广泛性的出血和淋巴组织的坏死为病变特征。在一些慢性或者亚临床病例中病变很轻或者几乎不存在病变。
病变主要发生在脾脏、淋巴结、肾脏、心脏等器官组织上。内脏器官广泛性出血。脾脏肿大、梗死, 呈暗黑色, 质地脆弱。淋巴结肿大、出血, 暗红色血肿, 切面呈大理石样。肾脏表明及皮质有点状出血。心包中含有猩红液体, 心内膜及浆膜可见斑点状出血。
在急性病例中, 还会出现其他病变, 例如, 腹腔内有浆液性出血性渗出物, 整个消化道黏膜水肿、出血。肝脏和胆囊充血, 膀胱黏膜斑点状出血。脑膜、脉络膜、脑组织发生较为严重的水肿出血。
亚急性型感染猪可见淋巴结和肾脏出血, 脾肿大、出血, 肺脏充血、水肿, 有时可见间质性肺炎。
慢性型感染猪可见肺实变或局灶性干酪样坏死和钙化。病程较长者, 大多发生纤维素性心包炎、肺炎以及关节肿大等慢性病变。
3.3 临床诊断
非洲猪瘟的临床症状和病变与猪的其他一些出血性、高度接触性传染病很相似, 比如, 猪瘟、高致病性蓝耳病、猪丹毒、败血性沙门氏菌等。因此, 我们很难或者说不能根据临床症状和眼观病变来判断是否为非洲猪瘟, 实验室检测是诊断该病最可靠、最准确的方法。

3.4 实验室诊断
从实验方法上分, 非洲猪瘟的实验室诊断主要有酶联免疫吸附试验 (ELISA) 、PCR、荧光定量PCR、DNA原位杂交、免疫组织化学检测、病毒分离、动物接种等多种方法, 另外, 一些新的方法正在被开发和评估, 比如检测抗原的侧流实验, 胶体金免疫层析试纸条, 检测抗体的免疫化学发光实验等等。但到目前为止, 生产实际中, 应用较多的还是Elisa、PCR以及荧光定量PCR等常用方法, 现将这几种方法进行简单介绍。
酶联免疫吸附试验 (ELISA) , 即利用抗原抗体进行免疫反应的定性和定量检测, 其已被广泛应用于生物医学领域。一般情况下, 非洲猪瘟病毒进入猪体内, 7d后便可诱导产生较高的Ig G抗体, 当然针对不同蛋白也会出现个别差异, 但不管怎样, 该方法仍是最为快速、方便的方法。当前, 市面上尚未使用非洲猪瘟相关疫苗, 因此只要抗体检测阳性, 便可确诊为非洲猪瘟病毒感染。刘丰等人便利用法国ID VET公司的非洲猪瘟抗体检测试剂盒对对黑龙江省18个边境县开展了非洲猪瘟的流行病学调查, 结果均为阴性。但非洲猪瘟引起的急性病例中需结合其它检测方法进行确诊, 因为机体可能尚未产生抗体便已死亡。
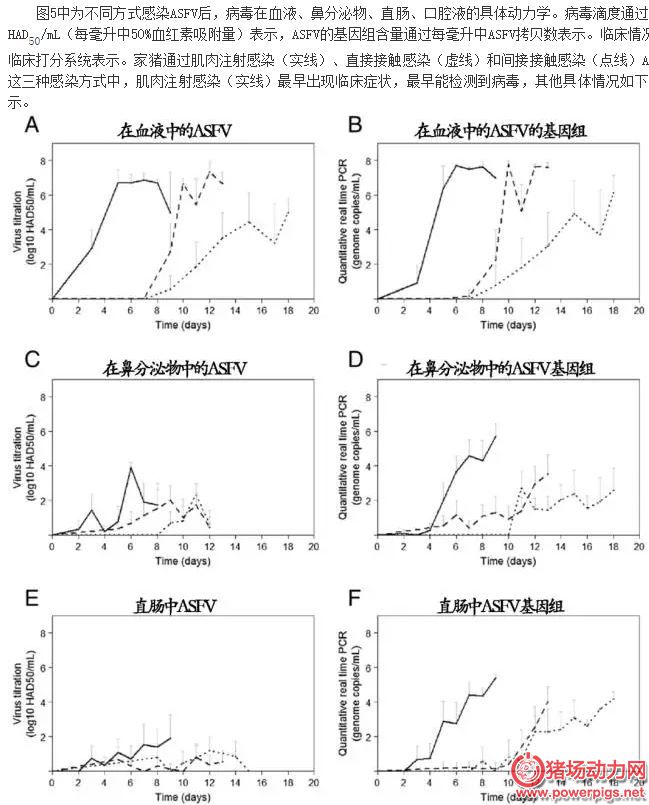
PCR, 聚合酶链式反应, 是体外扩增基因的一种方法。研究表明, 非洲猪瘟感染8h, 便可从血液中检测到其核酸物质, 因此, 针对非洲猪瘟病毒保守区域设计引物, 对采集的血液或组织病料等相关物质进行DNA提取, 进行PCR反应, 可对其进行快速准确诊断。荧光定量PCR, 通俗讲是PCR的升级版, 其更加敏感、准确。
3.4.1、 血清学检测方法
3.4.1.1 酶联免疫吸附试验 (ELISA)
ELISA应用于血清抗体的检测, 具有操作方便、特异性较好、灵敏度高的特点, 适用于大批量样品的检测, OIE将ELISA作为诊断ASF的首选血清学方法。ASFV含有约150种蛋白, 目前国内外常用作检测抗原的蛋白有VP73、VP72、P54、P32、P30等。Wardly等[1] (1979) 首次建立了间接ELISA方法检测ASFV抗体, 具有较好的敏感性和特异性。Pastor等[2] (1990) 分别以ASFV主要结构蛋白VP73和病毒感染的细胞培养物中高特异胞质可溶性抗原 (CS-P) 建立了两种间接ELISA方法, 两种方法特异性均较高, 但是CS-P抗原比VP73抗原至少能提前2d检测出ASFV抗体。Vidal等[3] (1997) 用VP73单抗建立的固相ELISA, 能够检测到浓度为0.5μg/m L的VP73抗原和2.3×102pfu/m L的全病毒颗粒。Hutchings等[4] (2006) 比较了用全病毒多抗血清和针对VP73蛋白的单抗进行间接夹心ELISA检测ASFV, 显示多抗血清的敏感性高于单抗。Perez等[5] (2006) 以昆虫细胞表达的P30重组蛋白为包被抗原, 建立了检测ASFV抗体的间接ELISA方法, 敏感性高, 可用于ASFV特异性抗体的早期检测。Gallardo等[6] (2009) 利用重组蛋白p K205R、p B602L、p104R和P54建立的ELISA检测方法具有较高的敏感性和特异性。蒋正军等[7] (2000) 以杆状病毒表达的ASFV VP72蛋白为抗原, 研究和组装了间接ELISA抗体检测试剂盒, 具有反应体系小、快速、特异等优点, 且比Dot-ELISA方法更加敏感。仇华磊[8] (2006) 采用大肠杆菌表达的GST-VP72融合蛋白为包被抗原, 建立了间接ELISA。朱红[9] (2007) 成功获得5株分泌抗ASFV VP72蛋白单克隆抗体的细胞株, 也建立了间接ELISA方法。李秋霞[10] (2010) 以大肠杆菌表达的ASFV p ET32a-VP73L重组蛋白作为包被原, 也建立了间接ELISA方法。曾少灵等[11] (2013) 利用杆状病毒表达载体在昆虫细胞中表达的ASFV的VP73重组蛋白作为检测抗原, 建立了间接ELISA方法。靳雯雯[12] (2014) 以VP73纯化蛋白作为包被抗原, 建立了间接ELISA方法, 与商品化的阻断ELISA相比, 其具有较好的敏感性和特异性。董志珍等[13] (2012) 针对ASFV P54蛋白建立了单克隆抗体竞争法ELISA并构建了检测试剂盒, 灵敏度高于间接免疫荧光 (IFA) 方法。梁云浩等[14] (2014) 利用Bac-toBac杆状病毒表达系统表达出的ASFV P54重组蛋白作为检测抗原建立了间接ELISA方法。邬旭龙等[15] (2016) 以原核表达的ASFV p K205R蛋白作为包被抗原, 建立了间接ELISA检测方法。张倩等[16] (2012) 采用瑞典Svanova ASFV间接ELISA抗体检测试剂盒对辽宁绥靖、内蒙古赤峰、大连东港共计92份猪血清进行了ASFV抗体的检测, 结果全部为阴性。邓飞等[17] (2016) 采用西班牙Ingenasa ASFV阻断ELISA抗体检测试剂盒对来源于四川省内的92份猪血清进行检测, 结果表明, 92份血清样本均为ASFV抗体阴性。
3.4.1.2 胶体金免疫层析 (GICA) 试纸条
张鑫宇等[18] (2014) 用原核表达的ASFV P54重组蛋白制备了ASFV抗体快速检测胶体金试纸条, 通过对ASFV不同感染时期141份猪血清样品进行比对检测, 显示该试纸条在感染早期的符合率高于OIE推荐的ELISA检测方法。刘波[19] (2014) 也运用原核表达系统和胶体金免疫层析技术, 对ASFV快速检测试纸条的技术进行了研究。吴海涛[20] (2015) 运用双抗体夹心法原理纯化后的抗ASFV单克隆抗体制备金标抗体, 制备了用于检测ASFV的胶体金免疫层析试纸条。
3.4.1.3 其他血清学方法
荧光抗体试验 (FAT) 可用于检测野外可疑猪或实验室接种猪的脾、淋巴结等组织压片和冰冻切片中的ASFV抗原。该方法具有快速、经济、敏感性和特异性高等优点, 但需要专业试验人员, 同时需要荧光显微镜及高质量的荧光标记抗体。因此仅作为ASFV的辅助检测方法。间接免疫荧光试验 (IFA) 可用于检测感染ASFV的猪血清样品。该方法的优点是当ELISA检测结果不确定或制备抗原困难或复杂时, 可选用此法。Malmquist等[21] (1960) 提出并建立了血细胞吸附试验方法, 血细胞吸附是指猪的红细胞附着在感染ASFV的单核细胞或者巨噬细胞的表面。绝大多数从非洲分离的ASFV毒株以及最初从欧洲国家分离的ASFV毒株均产生猪红细胞吸附现象。Pan等[22] (1978) 应用免疫过氧化物酶噬斑染色技术, 对接种ASFV的Vero细胞进行检测, 3d后观察到噬斑。可对ASFV进行抗原定量分析。此方法快速、特异, 不用借助其他仪器, 肉眼便可观察结果。Pastor等[23] (1992) 用细胞质可溶性抗原CS-P, 建立了斑点免疫 (DIA) 检测方法, 敏感性与OIE推荐的ELISA方法相当。Marco等[24] (2007) 建立了免疫组化法, 用来检测急性感染ASFV猪的扁桃体组织病理学变化, 通过检测发现, 感染ASFV猪有出血、单核细胞增多现象。免疫组化法是通用的检测方法之一, 但对于临床症状不明显的病例, 确诊有一定难度, 因此, 该方法仅作为ASFV的辅助检测方法。
3.4.2、分子生物学检测方法
3.4.2.1 PCR
PCR具有简单快速、灵敏度高和特异性强的优点, 是目前ASFV最常用的实验室检测方法。Aguero等[25] (2003) 和曾少灵等[26] (2009) 先后根据ASFV VP72基因设计引物, 建立了ASFV的PCR检测方法, 均具有良好的敏感性和特异性, 可以检测出极低含量的ASFV, 为ASFV早期感染的快速诊断提供了有效的分子生物学检测方法。Aguero等[27] (2004) 和张倩[28] (2010) 先后建立了一步法多重RT-PCR方法, 能够鉴别诊断猪瘟病毒 (Classical Swine Fever Virus, CSFV) 和ASFV, 可以从临床样品 (如抗凝全血、细胞培养物和组织) 中检测到病毒, 这为早期快速、特异性诊断非洲猪瘟和猪瘟提供了可靠的方法。Basto等[29] (2006) 建立了检测蜱ASFV的套式PCR方法, 敏感性高于OIE推荐的PCR检测方法。Giammarioli等[30] (2008) 建立了检测CSFV、ASFV、猪圆环病毒2型 (PCV2) 、猪繁殖与呼吸综合征病毒 (PRRSV) 和猪细小病毒 (PPV) 5种病毒的多重PCR检测方法, 可以用于这5种病毒感染的鉴别诊断。崔尚金等[31] (2012) 建立了ASFV的高效纳米PCR检测方法, 该方法采用纳米金颗粒作为热导介子, 提高了PCR反应效率。敏感性试验表明, 纳米PCR是常规PCR检测技术敏感性的1, 000倍以上, 最低核酸拷贝数检出量可以达到10个拷贝。采用该方法对黑龙江、吉林和河南3个省份临床送检的69份样品进行检测, 结果均为阴性, 表明该地区均无ASFV感染情况。
3.4.2.2 荧光定量PCR
实时荧光定量PCR比常规PCR具有更高的敏感性和特异性, 可同时快速检测大批量样品。King等[32] (2003) 、李维彬等[33] (2007) 、张泉等[34] (2007) 、黄萍等[35] (2010) 、Tignon等[36] (2011) 、李洪利等[37] (2012) 先后根据ASFV VP72基因, 曾少灵等[38] (2010) 根据VP73基因, 董志珍等[39] (2009) 根据P54基因各自设计引物和探针, 建立了Taq Man实时荧光定量PCR方法。Mc Killen等[40] (2007) 建立的实时荧光定量PCR分子信标 (molecular beacon) 技术具有快速、特异性强、灵敏性和准确性高的特点。该检测方法可快速鉴别PRV、ASFV、PCV2和PPV。郭少平等[41] (2010) 根据ASFV K205R基因序列设计合成引物及Taq Man探针, 建立了基于K205R基因的ASFV实时荧光定量PCR检测方法。Mc Killen等[42] (2010) 根据9GL基因建立了MGB探针实时荧光定量PCR检测方法, 最低可以检测到20拷贝标准DNA。该方法检测临床样品中的ASFV, 敏感性与OIE推荐Taq Man荧光定量PCR方法相当。Fernandez等[43] (2013) 利用通用探针库建立了ASFV的实时荧光定量PCR方法。陈静静等[44] (2012) 建立了双重荧光定量PCR, 可同时检测CSFV和ASFV, 只需一步即可完成, 可作为鉴别两种病毒的诊断方法。王建华等[45] (2016) 根据ASFV CP530R基因和高致病性猪繁殖与呼吸综合征病毒 (HP-PRRSV) NSP2基因为靶序列, 分别设计特异性引物和Taq Man-MGB探针, 建立了一种可同时鉴别检测ASFV和HP-PRRSV的二重荧光定量RT-PCR方法。
3.4.2.3 重组酶聚合酶扩增 (RPA) 技术
RPA是一种可以替代传统PCR的新型核酸检测技术, 该方法操作简单、反应快速、检测成本低、结果确实可靠, 王建昌等[46] (2016) 基于ASFV VP72基因保守序列设计并合成引物, 建立了ASFV RPA等温检测方法, 为ASFV的一线防控提供了一种新的、可靠的技术支持。
3.4.2.4 线性指数聚合酶链式反应 (LATE-PCR) 技术
LATE-PCR是不对称PCR的一种形式, 该方法用于检测组织样品的病毒, 其敏感性可以达到大约1拷贝的病毒DNA。Ronish等[47] (2011) 基于ASFV VP72基因建立了LATE-PCR方法, 为ASFV的实验室诊断提供了敏感的检测方法。
3.4.2.5 环介导恒温扩增 (LAMP) 技术
LAMP技术操作简单、灵敏、快速, 检测成本远低于荧光定量PCR, 且不需要特殊仪器设备, 具有较高的临床实用性。江彦增等[48] (2009) 、王彩霞等[49] (2010) 、杨吉飞等[50] (2011) 先后根据ASFV VP72基因序列设计引物, 建立了快速检测ASFV的LAMP方法, 最低检测限可达10拷贝质粒DNA, 且具有良好的特异性。邬旭龙[51] (2014) 根据ASFV K205R基因序列设计引物, 建立了LAMP检测方法。LAMP方法不需要PCR中的变性、退火步骤即可进行靶序列的循环扩增, 不但大大缩短了时间, 且使反应能够在恒温条件下进行, 无需特殊仪器设备, 肉眼判读, 可以满足基层快速诊断的需要, 非常适合于基层兽医实验室和养殖场使用。
3.4.2.6 探针杂交技术
张鑫宇等[52] (2011) 针对ASFV VP72基因分别设计合成1条与保守区域互补的5’生物素标记及3’烷巯基修饰短链寡核苷酸探针, 并将烷巯基修饰的探针吸附到纳米金颗粒上, 制备纳米金标记探针, 将PCR扩增产物与生物素探针及纳米金标记探针进行杂交, 杂交产物加入吸附链霉亲和素的酶标板, 利用亲和原理, 捕获杂交产物, 银染增强法对纳米金标记探针进行信号放大, 进而建立了检测ASFV VP72基因的纳米金探针杂交方法。探针杂交技术检测灵敏度高, 能有效排除PCR检测过程中的非特异性结果, 省去了琼脂糖凝胶电泳步骤, 操作简便、检测迅速, 在酶标板中可批量反应, 为ASFV核酸检测方法开辟了新的途径, 但该方法的建立难度较高、操作较繁琐, 对试验人员技术水平要求较高。
4 风险分析
根据非洲猪瘟病毒流行特点及当前形势, 非洲猪瘟传入我国的风险日益加大, 风险因素主要包括以下几个方面:
(1) 非洲猪瘟疫情国家逐年增多, 邻国俄罗斯疫情严峻;
(2) 我国与多个国家贸易往来频繁;
(3) 我国出境及进境游客人数多;
(4) 我国生猪及猪肉相关制品进口量大;
(5) 口岸中生活垃圾与各种废弃物的未安全处理;
(6) 中俄边境地区野猪的流动;
(7) 我国仍以中小规模猪场为主, 且猪场生物安全意识较差;
(8) 由于价差, 存在非法动物产品贸易等现象;
(9) 不排除恐怖组织及其它敌对势力对我国的生物袭击。
5 防控措施
5.1 普及非洲猪瘟相关知识
加大非洲猪瘟危害的宣传力度, 引起全民重视。非洲猪瘟一旦传入我国, 危害巨大, 且必将造成一系列的连锁反应, 影响人们正常生活。因此, 防范非洲猪瘟传入我国, 不仅仅是各地方动物疾控中心、各出入境有关部门、兽医工作者的职责, 更是我们每个人应尽的义务。外出旅游及工作人员, 不去疫情地区, 不从疫情地区携带相关猪肉制品进境;个别生猪及猪肉商贩, 要做良心买卖, 不进行非法走私买卖活动。
5.2 加大国家、政府职能
及时准确掌握贸易国的疫情史和近期疫情状况, 发布贸易禁令, 严禁与疫情国家进行贸易往来;强化监测预警, 开展省级和区域性兽医实验室建设, 加大检疫力度;加强防疫监管, 各边境省份, 切实落实边境巡查、检疫监管、消毒灭源等综合防控措施;建立边境疫情防范屏障, 对监测带内的家猪和野猪群进行采样监测, 做到“早发现、快报告、速诊断、严处置”;加强对往来疫情国家的游客检疫, 严禁游客从疫情国家地区携带猪肉制品进境;另外, 积极引导边境地区养殖户杜绝散养散放, 发展规模养殖, 实行严格的防疫消毒措施, 做好生物安全措施。
5.3 强化应急准备
相关部门举行突发非洲猪瘟疫情演练, 严格疫情处置, 一旦发现疫情, 按非洲猪瘟防治技术规范和防控应急预案规范处置。
5.4 研制安全有效的疫苗
相关部门可组织进行科研攻关, 致力于非洲猪瘟的疫苗研发, 防患于未然。
虽然我国历史上从未发生过非洲猪瘟, 但从全球范围看, 非洲猪瘟疫情愈发严重, 因此, 我们每个人尤其动物检疫、兽医相关从业者应齐心协力, 严防非洲猪瘟传入我境。
5.5、 高度重视, 常抓不懈
我国虽未发生非洲猪瘟, 但俄罗斯的非洲猪瘟疫情呈现向东部快速蔓延趋势, 当前防范非洲猪瘟重大动物疫情形势十分严峻。各级政府和兽医主管部门应当高度重视防范非洲猪瘟重大动物疫情, 由各级人民政府统一领导和指挥突发疫情的应急工作, 定期进行应急突发事件演练, 召开防控专题工作会议。各部门按照各自工作职责明确分工, 切实把防范工作落到实处, 做好应对非洲猪瘟传入的各种可能。
5.6、加强巡查, 严防不待
边境市县畜牧兽医局成立边境地区动物防疫巡查工作领导小组, 负责本地区动物防疫巡查工作的组织、检查、督导。对距离边境线5公里和30公里范围内所辖的村屯畜禽养殖情况进行彻底调查统计, 按要求填写调查问卷和调查表格, 及时掌握边境地区动物养殖、免疫、流通、屠宰等各环节, 特别边境沿线附近乡 (镇) 村屯、野生动物频繁出没地区等重点区域的风险因素变化, 实施科学的预警预报, 确保做到“早发现、快报告、严处置”。
5.7、构筑免疫隔离带
搞好免疫是做好防控工作的重中之重, 提高免疫密度是防止疫情发生最有效的保证。开展动物防疫工作要统一组织、统一时间、统一行动, 逐头注射、逐户排查、逐村推进, 不留死角, 按照建立边境强制免疫保护带的要求, 距离边境线30公里范围内的乡镇村屯, 要再加强一次疫苗的免疫注射, 构筑起坚固的防疫屏障。
5.8、强化督导检查
选派业务素质较高、实践经验丰富的专业技术人员, 成立重大动物疫病区域督导小组, 负责动物防疫工作的监督检查, 采取会战期间蹲点, 平时随机抽检的督导方式, 真正深入到基层, 重点检查指导非洲猪瘟防范和重大动物疫病防控工作, 随时发现问题随时解决。同时, 公布防疫监督举报电话, 落实专人, 24小时接听群众举报, 对举报情况及时派人到现场调查核实, 将疫情控制在萌芽状态。
5.9、加强疫情监测
采取“日常监测兼顾全面、集中监测突出重点”的原则, 进行口蹄疫、高致病性禽流感、鸡新城疫、猪瘟等免疫抗体检测工作, 准确掌握免疫状况, 为制定科学合理的免疫程序提供依据。非洲猪瘟监测采用现场调查和采样检测相结合的方法, 全年开展两次流行病学调查及采样送检, 按时完成流调和送检任务, 发现可疑病例, 按照防治技术规范和应急预案进行报告。
5.10、加强联防联控, 形成防控合力
加强与出入境检验检疫局等部门密切配合, 强化联防联控, 保持信息沟通, 及时掌握国内外动物疫情信息, 加强口岸、非口岸通道管理, 组织联防巡查, 加大查验、检疫和消毒力度。严厉打击动物及其产品走私活动, 严禁进口非洲猪瘟疫情国家和地区的猪、野猪及相关产品, 坚决防止境外疫情传入。
5.11、加大宣传, 群防群控
通过广播、电视、网络、张贴标语、发放宣传单、科技赶场等多种形势, 广泛宣传非洲猪瘟防范知识和防控政策, 积极倡导距边境3公里以内范围限制饲养畜禽、距边境3~5公里以内全封闭饲养畜禽, 尽量避免野生动物与家养动物的接触, 要严格防止野生动物越境, 对越境动物实施驱逐, 降低易感动物感染几率。增强进出境旅客和相关从业人员的防范意识, 营造群防群控的良好氛围。
6、疫苗进展
6.1、灭活疫苗
传统病毒疫苗可通过病毒灭活和病毒致弱两种方法进行制备。灭活疫苗通过物理或化学手段将病原灭活, 使其失去感染能力, 但保留其抗原性。迄今为止, 采用多种传统方法制备的ASF灭活疫苗均不能对强毒攻击提供有效的免疫保护[7,8], 包括病毒接种肺泡巨噬细胞以及感染脾组织后匀浆制备的灭活疫苗。虽然用ASF灭活疫苗免疫后可产生高效价的抗体, 但很难检测到中和抗体的存在。Blome等[9]研究表明, 即使用新型佐剂PolygenTM或Emulsigen (®) -D等与ASFV灭活抗原进行配伍, 免疫动物后能够诱导产生ASFV特异性抗体, 但仍未能提高疫苗的免疫保护效力。这可能是由于产生的ASFV特异性抗体并不具有中和活性, 提示细胞免疫在ASF疫苗免疫保护中起重要作用。此外, GómezPuertas等[10]研究人员也证实在细胞传代过程中, 低代次和高代次的ASFV毒株对中和抗体的敏感性存在差异。鉴于现有研究结果, 采用传统方法研制有效的ASF灭活疫苗困难很大。
6.2、减毒活疫苗
根据减毒活疫苗毒株来源不同, 可将ASF减毒活疫苗毒株分为三类:传代致弱毒株、天然致弱毒株和重组致弱毒株。减毒活疫苗能够诱导强烈持久的免疫应答, 但生物安全是其使用的主要限制因素。采用分子生物学手段, 可通过基因重组、靶向缺失以及一次性侵染技术来增强减毒活疫苗的安全性。
6.2.1 传代致弱毒株
ASFV可经过猪骨髓来源细胞、Vero和COS-1等细胞系传代致弱。传代过程中, ASFV致病力逐渐下降, 同时病毒免疫原性和稳定性也随之下降。在西班牙和葡萄牙, 使用传代致弱毒株免疫动物后产生了灾难性的后果, 免疫动物呈现出肺炎、流产和死亡等副作用, 在田间多次感染和异源强毒株存在的条件下, 许多免疫动物呈现ASF慢性感染临床症状。因此, 传代致弱毒株的致病性导致此类疫苗的开发一度受阻。Krug等[11]利用分离株ASFV-G在Vero细胞中进行传代培养, 随着传代次数的增加, ASFV-G在Vero细胞中的复制能力增强, 同时在猪原代巨噬细胞中的复制能力下降, 病毒毒力逐渐衰减, 在传至第110代时完全丧失。家猪接种完全致弱的ASFV-G毒株后并未获得相应保护力, 以抵抗母本病毒的攻击[11], 表明传代致弱的ASFV安全性较差且很难提供较好免疫保护。
6.2.2 天然致弱毒株
采用天然致弱A S F V毒株OURT88/3或NH/P68免疫动物后, 能诱导产生对同源强毒株的攻毒保护, 依据实验动物和攻毒毒株的不同, 保护率介于66%~100%[12-15]。研究表明, 病毒特异性抗体以及CD8+T细胞在免疫保护中均起重要作用, 且OURT88/3毒株产生的免疫保护与病毒特异性IFN-γ产生细胞呈正相关性。采用NH/P68免疫后, 猪对高毒力ASFV/L60感染抵抗力增强[13]。以OURT88/3免疫并用致病性OURT88/1毒株进行加强免疫后, 可诱导机体产生针对ASFV I型不同分离毒株的交叉保护[12], 表明研制具有交叉保护的ASFV疫苗是可能的。然而, 天然致弱毒株免疫动物后可造成诸多副反应, 包括肺炎、流产、死亡等, 免疫NH/P68毒株后25%~47%的猪呈现慢性感染[13];免疫OURT88/3后可导致发热、关节肿胀等症状[15]。总之, 天然致弱毒株导致的诸多副反应以及存在散毒的可能性等生物安全隐患限制了其在实际生产中的进一步应用。
6.2.3 重组致弱毒株
采用分子生物学方法, 敲除病毒功能基因、病毒毒力基因或者免疫抑制基因, 可降低病毒毒力或增加机体对病毒的免疫应答, 研制比传统弱毒疫苗安全性更好且效力更高的基因工程减毒活疫苗。研究表明, 一些ASFV毒株在缺失单个或多个毒力基因/或免疫抑制基因后, 如TK (K196R) 、9GL (B119L) 、CD2v (EP402R) 、DP148R、NL (DP71L) 、UK (DP96R) 和多基因家族360和505 (MGF 360/505) , 缺失毒株接种宿主毒力减弱且可诱导产生针对同源母本毒株或异源毒株的特异性免疫保护 (表1) [16-19]。ASFV编码多种蛋白以干扰宿主免疫系统, 已报道的病毒免疫逃逸相关基因包括A238L、A179L、A224L、DP71L、MGF360/505、I329L、K205R、D96R、DP148R、A276R、D96R和EP153R等, 其编码蛋白抑制宿主细胞Ⅰ型干扰素和ISGs的产生, 调控细胞凋亡、蛋白合成和自噬等多种信号通路[19-23]。由于这些蛋白质可干扰宿主免疫应答, 从ASFV强毒株中缺失上述基因有助于增强宿主免疫应答 (表1) 。
安全性和有效性是影响ASF弱毒活疫苗田间应用的重要因素, 安全性和有效性与病毒毒株、免疫或感染剂量、病毒接种途径以及接种动物密切相关。因此, 致弱毒株保护性的强弱、是否有毒力残留和是否导致持续感染是弱毒活毒株能否成为候选疫苗毒株的重要决定因素。因此, 还需要进一步研究以确定适合的缺失靶基因及其组合, 以研制可诱导保护性免疫反应且没有相应副作用的ASFV弱毒活疫苗。
表1 减毒活疫苗研究进展Table 1 Progress towards the development of ASFV live attenuated vaccines

6.3 病毒活载体疫苗
已有研究表明, 细胞免疫和体液免疫在抗ASFV感染中发挥作用[24-26]。有学者将ASFV保护性抗原重组入腺病毒或痘病毒载体, 以期获得更好的细胞免疫和CTL反应。Lokhandwala等[27]将ASFV p32、p54、p72和pp62基因分别重组入人腺病毒Ad5载体中进行“鸡尾酒”式免疫, 获得了良好的抗原特异性CTL反应;之后他们又将ASFV A151R、B119L、B602L、EP402RΔPRR、B438L和K205R-A104R共7个ASFV抗原基因, 重组入复制缺陷型腺病毒载体, 通过“鸡尾酒”式混合免疫后能够诱导强烈体液免疫反应和细胞免疫应答[28]。上述研究仍需通过攻毒保护试验, 进一步验证病毒活载体疫苗在ASF疫苗开发中的可行性。
6.4 核酸疫苗
ASF核酸疫苗的研究刚刚起步, 通过将编码病毒主要抗原的基因克隆入真核表达载体后, 直接导入机体内, 在宿主细胞内完成转录翻译后产生抗原蛋白, 从而同时激活体液免疫和细胞免疫应答。Argilaguet等将ASFV p72、p30和p54基因克隆入真核表达载体, 制备ASF DNA疫苗, 但该DNA疫苗免疫猪后并不能够提供攻毒保护[29,30]。同组科研人员将ASFV p30和p54基因与猪白细胞抗原II的特异性抗体单链可变区基因在真核表达载体中融合表达;接种ASF DNA疫苗后, 在没有诱导产生可检测水平ASFV抗体的情况下, 能够使部分动物获得攻毒免疫保护, 表明细胞免疫在ASFV疫苗的免疫中起重要作用[30]。最新研究表明, 根据一个或两个ASFV抗原构建的DNA疫苗并不能诱导较高免疫保护, 而免疫ASFV基因组DNA质粒表达文库能够提供60%的保护力, 说明有待于发掘更多保护性抗原, 以提高核酸疫苗的保护水平[31]。
6.5 亚单位疫苗
ASF亚单位疫苗只包含特定的病毒抗原, 需通过合适抗原传递系统免疫动物。鉴定可以引起强烈的免疫应答的抗原及其表位, 有助于开发有效的ASFV亚单位疫苗。研究表明, 针对病毒p30蛋白的抗体在细胞水平抑制超过95%的ASFV内化, p72和p54的抗体能够抑制病毒吸附, 表明这些蛋白在ASFV感染中发挥作用。用重组p30或p54蛋白免疫猪后可以诱导中和抗体的产生, 但不能提供针对急性ASF感染的保护[32];相比之下, 同时免疫p30和p54蛋白或两种蛋白的嵌合体可以提供部分保护[32,33]。用杆状病毒表达系统制备的ASFV结构蛋白p72、p30和p54等, 以蛋白复合物作为抗原免疫动物后仍不能提供有效的免疫攻毒保护[32-34], 说明仅仅依靠上述抗原刺激产生的中和抗体很难获得理想的免疫保护效果。在另一组研究中, Lopera-Madrid等[35]分别以人源293 (HEK) 细胞表达的ASFV B646L (p72) 、E183L (p54) 和O61R (p12) 亚单位抗原, 或者痘苗病毒载体疫苗进行首免和加强免疫, 获得较好的体液免疫和细胞免疫水平。因此, 需要研究鉴定更多的ASFV保护性抗原、开发新型免疫佐剂以及采用DNA首免蛋白质加强免疫策略, 以提高ASF基因工程亚单位疫苗的免疫效力。
参考文献
[1]赵德明, 等.猪病学[M].10版.北京:中国农业大学出版社, 2014:408-416.
[2]Fauquet C.et al.Virus taxonomy:VIIIth report of the International Committee on Taxonomy of Viruses[M].Academic Press, 2005.
[3]戈胜强, 等.非洲猪瘟在俄罗斯的流行与研究现状[J/OL].微生物学通报, :1-11 (2017-0907) .
[4]邓俊花, 等.非洲猪瘟研究新进展[J].中国动物检疫, 2017, 34 (08) :66-71.
[5]Achenbach J E, et al.Identification of a new genotype of African swine fever virus in domestic pigs from Ethiopia[J].Transboundary and emerging diseases, 2017, 64 (5) :1393-1404.
[6]周伟伟, 等.基于非洲猪瘟研究现状下的风险防控研究[J].中国兽医杂志, 2017, 53 (05) :112-114+124.
[7]孙洪涛, 等.2015年全球非洲猪瘟流行状况分析[J].中国动物检疫, 2016, 33 (12) :1-3.
[8]翁善钢.2016年国际猪病疫情回顾:非洲猪瘟仍是头号威胁[J].养猪, 2017, (02) :96.
[9]刘丰, 等.黑龙江省非洲猪瘟流行病学调查和监测结果分析[J].畜牧兽医科技信息, 2017, (09) :33-34.
[1]戈胜强, 吴晓东, 李金明, 等.巴西非洲猪瘟根除计划的经验与借鉴[J].中国兽医学报, 2017, 37 (5) :961-964.
[2]CHAPMAN D A G, TCHEREPANOV V, UPTON C, et al.Comparison of the genome sequences of nonpathogenic and pathogenic African swine fever virus isolates[J].J Gen Virol, 2008, 89 (2) :397-408.
[3]DE VILLIERS E P, GALLARDO C, ARIAS M, et al.Phylogenomic analysis of 11complete African swine fever virus genome sequences[J].Virology, 2010, 400 (1) :128-136.
[4]GONZALEZ A, TALAVERA A, ALMENDRAL J M, et al.Hairpin loop structure of African swine fever virus DNA[J].Nucleic Acids Res, 1986, 14 (17) :6835-6844.
[5]DIXON L K, ABRAMS C C, CHAPMAN D G, et al.African swine fever virus[M].Caister A P:Anim Viruses Mol Biol, 2008:457-521.
[6]DIXON L K, CHAPMAN D A G, NETHERTON C L, et al.African swine fever virus replication and genomics[J].Virus Res, 2013, 173 (1) :3-14.
[7]SALAS M L, ANDRES G.African swine fever virus morphogenesis[J].Virus Res, 2013, 173 (1) :29-41.
[8]GaLLARDO C, MWAENGO D M, MACHARIA J M, et al.Enhanced discrimination of African swine fever virus isolates through nucleotide sequencing of the p54, p72, and pB602L (CVR) genes[J].Virus Genes, 2009, 38 (1) :85-95.
[9]GALLARDO C, ANCHUELO R, PELAYO V, et al.African swine fever virus p72genotypeⅨin domestic pigs, Congo, 2009[J].Emerg Infect Dis, 2011, 17 (8) :1556-1558.
[10]BASTOS A D S, PENRITH M L, CRUCIERE C, et al.Genotyping field strains of African swine fever virus by partial p72gene characterisation[J].Arch Virol, 2003, 148 (4) :693-706.
[11]RODRIGUEZ J M, GARCIA-ESCUDERO R, SALAS M L, et al.African swine fever virus structural protein p54is essential for the recruitment of envelope precursors to assembly sites[J].J Virol, 2004, 78 (8) :4299-4313.
[12]ALONSO C, MISKIN J, HERNAEZ B, et al.African swine fever virus protein p54interacts with the microtubular motor complex through direct binding to light-chain dynein[J].J Virol, 2001, 75 (20) :9819-9827.
[13]SUAREZ C, SALAS M L, RODRIGUEZ J M.African swine fever virus polyprotein pp62is essential for viral core development[J].J Virol, 2010, 84 (1) :176-187.
[14]ANDRES G, ALEJO A, SALAS J, et al.African swine fever virus polyproteins pp220and pp62assemble into the core shell[J].J Virol, 2002, 76 (24) :12473-12482.
[15]MALOGOLOVKIN A, BURMAKINA G, TULMAN E R, et al.African swine fever virus CD2vand C-type lectin gene loci mediate serological specificity[J].J Gen Virol, 2015, 96 (4) :866-873.
[16]PEREZ-N U’NEZ D, GARCIA-URDIALES E, MARTINEZ-BONET M, et al.CD2vinteracts with adaptor protein AP-1during African swine fever infection[J].PLoS One, 2015, 10 (4) :1-19.
[17]COSTARD S, WIELAND B, DE GLANVILLE W, et al.African swine fever:how can global spread be prevented[J].Philosophi Transacti Royal Soci London B:Biol Sci, 2009, 364 (1530) :2683-2696.
[18]COSTARD S, MUR L, LUBROTH J, et al.Epidemiology of African swine fever virus[J].Virus Res, 2013, 173 (1) :191-197.
[19]SANCHEZ-VIZCAINO J M, MUR L, MARTINEZLIPEZ B.African swine fever:an epidemiological update[J].Transbound Emerg Dis, 2012, 59 (s1) :27-35.
[20]OGANESYAN A S, PETROVA O N, KORENNOY F I, et al.African swine fever in the Russian Federation:Spatio-temporal analysis and epidemiological overview[J].Virus Res, 2013, 173 (1) :204-211.
[21]SANCHEZ-VIZCAINO J M, MUR L, MARTINEZLOPEZ B.African swine fever (ASF) :five years around Europe[J].Vet Microbiol, 2013, 165 (1) :45-50.
[22]MALOGOLOVKIN A, BURMAKINA G, TITOV I, et al.Comparative analysis of African swine fever virus genotypes and serogroups[J].Emerg Infect Dis, 2015, 21 (2) :312-315.
[23]PENRITH M L, VOSLOO W, JORI F, et al.African swine fever virus eradication in Africa[J].Virus Res, 2013, 173 (1) :228-246.
[24]JORI F, VIAL L, PENRITH M L, et al.Review of the sylvatic cycle of African swine fever in sub-Saharan Africa and the Indian ocean[J].Virus Res, 2013, 173 (1) :212-227.
[25]SANCHEZ-VIZCAINO J M, MUR L, GOMEZ-VILLAMANDOS J C, et al.An update on the epidemiology and pathology of African swine fever[J].J Comp Pathol, 2015, 152 (1) :9-21.
[26]ATUHAIRE D K, AFAYOA M, OCHWO S, et al.Prevalence of African swine fever virus in apparently healthy domestic pigs in Uganda[J].BMC Vet Res, 2013, 9 (1) :1-8.
[27]JORI F, VIAl L, RAVAOMANANA J, et al.The role of wild hosts (wild pigs and ticks) in the epidemiology of African swine fever in West Africa and Madagascar[C]//Proceedings of the 12th International Conference of the Association of Institutions for Tropical Veterinary Medicine (AITVM) , Montpellier, France, 2007:79-83.
[28]MISINZO G, MAGAMBO J, MASAMBU J, et al.Genetic characterization of African swine fever viruses from a 2008 outbreak in Tanzania[J].Transbound Emerg Dis, 2011, 58 (1) :86-92.
[29]UTTENTHAL A, BRAAE U C, NGOWI H A, et al.ASFV in Tanzania:Asymptomatic pigs harbor virus of molecular similarity to Georgia 2007[J].Vet Microbiol, 2013, 165 (1) :173-176.
[30]LUKA P D, ACHENBACH J E, MWIINE F N, et al.Genetic characterization of circulating African swine fever viruses in Nigeria (2007-2015) [J].Transbound Emerg Dis, 2017, 64 (5) :1598-1609.
[31]ACHENBACH J E, GALLARDO C, NIETO-PELEGRIN E, et al.Identification of a new genotype of African swine fever virus in domestic pigs from Ethiopia[J].Transbound Emerg Dis, 2017, 64 (5) :1393-1404.
[32]ATUHAIRE D K, AFAYOA M, OCHWO S, et al.Molecular characterization and phylogenetic study of African swine fever virus isolates from recent outbreaks in Uganda (2010-2013) [J].Virol J, 2013, 10 (1) :1.
[33]SANCHEZ-VIZCAINO J M, MUR L, MARTINEZLOPEZ B.African swine fever (ASF) :five years around Europe[J].Vet Microbiol, 2013, 165 (1) :45-50.
[34]OLSEVSKIS E, GUBERTI V, SERZANTS M, et al.African swine fever virus introduction into the EU in2014:Experience of Latvia[J].Res Vet Sci, 2016, 105:28-30.
[35]GALLARDO C, MWAENGO D M, MACHARIA J M, et al.Enhanced discrimination of African swine fever virus isolates through nucleotide sequencing of the p54, p72, and pB602L (CVR) genes[J].Virus Genes, 2009, 38 (1) :85-95.
[36]GOGIN A, GERASIMOV V, MALOGOLOVKIN A, et al.African swine fever in the North Caucasus region and the Russian Federation in years 2007-2012[J].Virus Res, 2013, 173 (1) :198-203.
[37]SANNA G, DEI GIUDICI S, BACCIU D, et al.Improved strategy for molecular characterization of African swine fever viruses from Sardinia, based on analysis of p30, CD2Vand I73R/I329Lvariable regions[J].Transbound Emerg Dis, 2016, 64 (4) :1280-1286.
[38]GALLARDO C, SOLER A, NIETO R, et al.Experimental Infection of domestic pigs with African swine fever virus Lithuania 2014genotypeⅡfield isolate[J].Transbound Emerg Dis, 2015, 64 (1) :300.
[39]CARMINA G, JOVITA F P, VIRGINIA P, et al.Genetic variation among African swine fever genotypeⅡviruses, eastern and central Europe[J].Emerg Infect Dis, 2014, 20 (9) :1544-1547.